PAPİLLOMA VİRÜS (HPV) AŞILARI
İlk kez Ekim 2002'de tıbbi literatüre giren koruyucu HPV aşıları ile ilgili çalışmalardan elde edilen bilgiler kısa sürede olgunlaşmış ve iki farklı aşı üretilerek insanlığın kullanımına sunulmuştur.
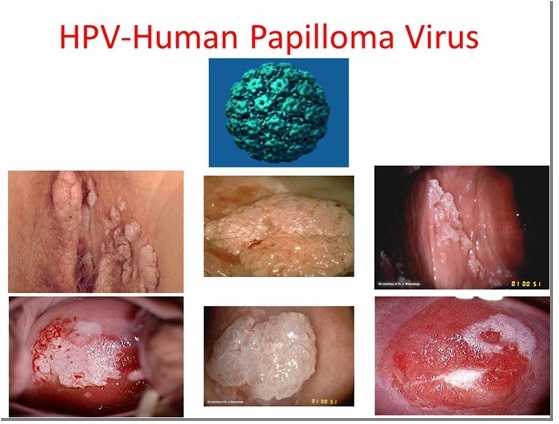
Merck-Sanofi-Pasteur firması tarafından üretilen aşı Gardasil® adını taşımaktadır ve kuadrivalan özelliktedir. Glaxo Smith Kline firmasının piyasaya sürdüğü aşı Cervarix® adındadır ve bivalan aşıdır. Koruyucu HPV aşılarında viral DNA mevcut değildir, güçlü immünojenik özellikleri mevcuttur, infeksiyöz ya da onkojenik potansiyelleri yoktur.
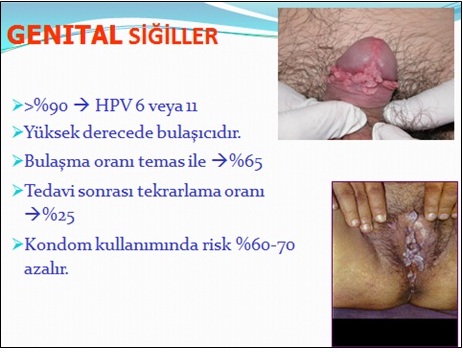
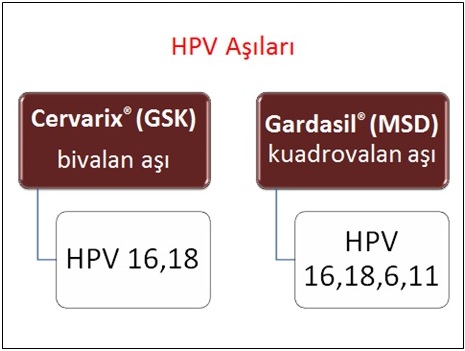
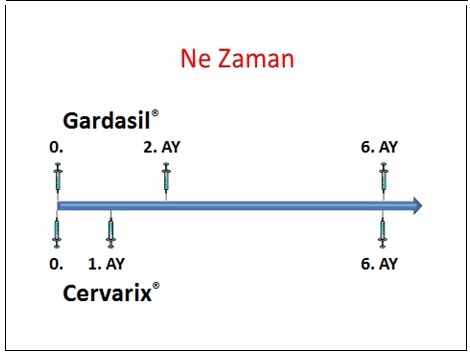

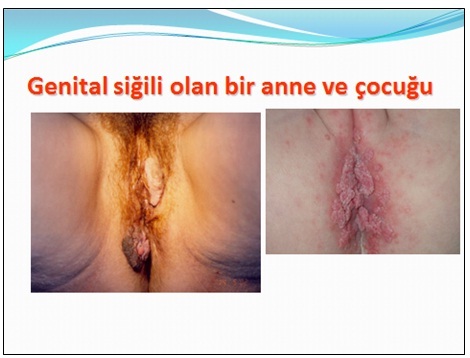
Gardasil® FDA'den onay alan ilk HPV aşısıdır ve Nisan 2007'den bu yana Türkiye piyasasında bulunmaktadır. FDA, HPV tip 6,11,16 ve 18 tarafından oluşturulan hastalıklardan (serviks kanseri,genital siğil,CIN,VIN ve VaIN gibi prekanseröz lezyonlar) korunmak için 9-26 yaş arasındaki kadınlarda bu aşının kullanımını önermiştir.ğer taraftan bivalan aşının (Cervarix®) kullanımını takiben 4.5 yıl sonunda immünojenik özelliğinin çok yüksek olduğu gösterilmiş ve HPV tip 16/18 infeksiyonu ve ilişkili servikal lezyonlara karşı çok yüksek düzeyde koruyuculuk sağladığı bildirilmiştir. Bivalan aşıyla ilgili en önemli avantaj, HPV tip 31 (16 nedeniyle) ve HPV tip 45 (18 nedeniyle)'e karşı çapraz koruma sağlayabilmesidir. Bivalan aşı HPV 45'e karşı %94, HPV 31'e karşı %55 oranında etkindir.HPV aşıları için asıl hedef kitle 11-12 yaşlarındaki kızlardır. Daha önce aşı uygulanmamışsa, 13-18 yaşlarındaki kızlar da aşılama için uygundur. Önceden aşılanmamışlarsa 19-26 yaş arasındaki kadınlar da aşılanabilirler ancak bu yaş grubunda aşının koruyuculuğu göreceli olarak daha azdır. Daha önce HPV ile infekte olmuş kadınlarda aşının daha az etkin olduğu aşikardır. Erkeklerde ve 27 yaş üzerindeki kadınlarda aşının kullanımına FDA onay vermemiştir.şılamanın erken adölesan dönemde önerilmesinin temel nedeni aşılamaya ilk cinsel ilişkiden önce başlanması gereğidir. Kızlar cinsel aktif yaşa gelmeden aşılamaya başlanmalıdır. Ülkemizde her yıl yaklaşık 70000 adölesan kızın evlendirildiği düşünüldüğünde bu tip bir yaklaşım ülkemiz için de uygun gözükmektedir. İmmünizasyon için toplam 3 doz aşılama önerilmektedir. Tek bir doz aşının ülkemizdeki fiyatı yaklaşık 240-260 YTL arasında değişmektedir. Ülkemizdeki ekonomik koşullar göz önüne alındığında aşının maliyeti çok önemli bir sorundur.
Özetle, kuadrivalan aşı (Gardasil®) kullanımında doğal HPV infeksiyonundaki antikor titrelerinin hafifçe üstünde antikor titreleri sağlanır. Kanserojen HPV tiplerinden sadece ikisine karşın etkindir (HPV tip 16,18). Diğer taraftan genital siğillere neden olan HPV tip 6 ve 11'e karşı koruyucudur.aşı (Cervarix®) kullanımında doğal HPV infeksiyonunda saptanan antikor titresinin oldukça üstünde, yüksek antikor titreleri elde edilir. Zaman geçtikçe antikor titrelerinde azalma söz konusu olmaz. Kanserojen HPV tiplerinden 4'üne karşı koruyuculuk sağladığı gösterilmiştir (HPV tip 16,18,31,45).ç olarak koruyucu HPV aşıları iyi tolere edilir ve yüksek oranda immünojeniktir. Yüksek antikor titreleri sağlayarak sebat eden HPV infeksiyonu ve ilişkili klinik hastalıklardan korunmada yüksek oranda etkindirler. kanseri korunulabilir bir kanserdir. Primer korunmada aşılama, sekonder korunmada tarama programlarının etkin bir şekilde uygulanması ulusal bir sağlık politikası haline getirilmelidir.
Aşısı: Bulunabilirliği, Çerçeve Koşulları, Uygulaması ve Güncel Bilgilerimiz.
Günümüzde mevcut HPV aşıları, servikal kanserlerin (rahim ağzı kanserlerinin) %70'inde izole edilebilen yüksek riskli HPV suşları 16 ve 18'in sebep olduğu enfeksiyonlara karşı koruma sağlamaktadır. Serviksteki hücresel değişimlerin %30'u diğer HPV suşlarına bağlı gelişmektedir.'da HPV aşılaması, Robert-Koch Enstitüsündeki kalıcı aşılama komisyonu tarafından (RKI'de STIKO) Temmuz 2007'den beri 12-17 yaş arasındaki kız çocuklarına standart aşı olarak uygulanmakta ve 1, 6 ve 12 ay aralıklarla temel immünizasyon olarak önerilmektedir. Almanya'da piyasada bulunan aşılar Gardasil® (Sanofi Pasteur, 9 yaş üzerindeki erkek ve kız çocukları için onaylanmış, HPV suşları 6, 11, 16 ve 18'e karşı immünizasyon sağlayan tetravalan aşı) ve Cervarix® (GSK, 10 yaş üstü kız çocukları için onaylanmış, HPV suşları 16 ve 18'e karşı immünizasyon sağlayan bivalan aşı) isimli ürünlerdir.şı başına maliyet hem Gardasil hem de Cervarix için 160 Euro tuttuğundan temel immünizasyon maliyeti yaklaşık 500 Euro civarındadır. Aşının maliyeti, STIKO önerisi doğrultusunda gerçekleştirildiği ölçüde devlet sağlık sigorta kurumlarınca karşılanmaktadır (Kasım 2007 itibariyle genel sigorta kapsamındadır). HPV aşıları hasta bazında karar doğrultusunda ve sigortaya yönelik yapılacak başvuru doğrultusunda 18 ile 26 yaş arasındaki kadınlarda da kısmen karşılanabilmektedir. Özel sağlık sigortasına sahip hastalarda sigorta aşılama maliyeti ilgili poliçenin kapsamına göre yine karşılanabilmektedir. Buna karşın aşı maliyetleri yurtdışında önemli ölçüde daha düşüktür (ABD: yaklaşık 275 Euro).® isimli ürünün avantajı HPV 6 ve 11 enfeksiyonlarına (Condylomata acuminata) karşı ek koruma sağlamasıyken Cervarix® için daha yüksek bir antikor titresi oluşturması ve buna bağlı olarak daha uzun bir koruma süresi avantaj olarak gösterilmektedir.enfeksiyonlarının önlenmesinde, 15-26 yaş arası kadınlar için %98-100 arası bir etkinlik gösterilebilirken buna ek olarak (%100'e varan ölçüde) prekanseröz (kanser ön aşaması), yani CIN I-III lezyonların insidansında anlamlı bir azalma olduğu da gösterilebilmiştir. Rahim ağzı (serviks) kanseri riskinde bir azalmaya dair bir kanıt, prekanseröz lezyondan invaziv kansere progresyon süresinin uzun olması nedeniyle (>10 yıl) henüz gösterilememiş olsa da çalışmaların uzun takip sürelerinde gerekli kanıtların elde edilmesi beklenmektedir.'da ve özellikle de Almanya'da HPV aşısının uygulanması ve endikasyonlarının belirlenmesi ile ilgili olarak şu bilgiler verilebilir:
Cinsel ilişkiye henüz girmemiş (11-14 yaşındaki) kız çocukları bu aşı için öncelikli hedef grubu teşkil etmektedir. Bağışıklığın asgari 5 yıl devam etmekle birlikte immünizasyonun 10 yıl devam edebileceği düşünülmektedir. Repel dozun zamanlaması henüz tam olarak belirlenememiştir.partner sayısının artışına paralel olarak aşının etkinliği, HPV'ye maruz kalmamış kız çocukları ve kadınlara kıyasla daha düşük olsa da, sayısı beşe varan cinsel partnerle ilişkiye girmiş, yaşları 15-26 arasında değişen genç kadınlara yapılan aşının da etkili olduğu Faz III çalışmalarında gösterilebilmiştir.16/18 veya diğer HVP suşları ile kanıtlanmış bir enfeksiyonun veya servikste displastik değişikliklerin varlığında terapötik bir etkinlik beklenmemelidir.
Çok sayıda başka onkojenik HPV suşu olduğundan ve HPV-16/18 dışı suşlara bağlı CIN lezyonu prevalensi yüksek olduğundan, aşılama sonrası da smear testleri yoluyla erken kanser taramalarına düzenli olarak devam edilmesi gerekmektedir. ç kadınlarda rapor edilen ölüm vakalarıyla HPV aşısı arasında bir sebep-sonuç ilişkisi henüz gösterilememiştir. Enjeksiyon yerinde ağrı, kızarıklık, şişme ve kaşıntı gibi lokal reaksiyonlar sık gözlenmektedir. Ateşin eşlik ettiği reaksiyonlar, solunum sıkıntısı ve ürtiker daha nadir görülmektedir.HPV suşları piyasada bulunan HPV testleriyle tespit edilemediğinden ve pozitif bir sonuçta dahi aşıda bulunan tüm virüs suşlarına bağlı bir enfeksiyon ancak düşük sayıda vakada tespit edildiğinden aşılama öncesi bir HPV testi yapılması tavsiye edilmemektedir. Dolayısıyla aşı o anda enfeksiyona yol açmamış olan ancak aşının kapsamında bulunan diğer HPV suşlarına karşı hala koruma sağlayabilmektedir.ünümüz itibariyle aşının gebelik döneminde güvenli kullanımıyla ilgili yeterli veri mevcut değildir. Ancak aşılama serisi sırasında gebe kalan kadınlarda, aşı yapılmamış gebelere kıyasla hem anne hem bebek sağlığı yönünden artmış bir risk saptanmamıştır. Yine de şu an itibariyle aşılama için gebeliğin sona ermesinin beklenmesi tavsiye dilmektedir. Bir kadının HPV aşısının kısmi bir dozunu aldıktan sonra hamile kalması durumunda, aşılamaya devam etmek için doğum sonrası dönem beklenmelidir.

